Vaistų veikimo mechanizmas ir atsparumas jiems
Chemoterapija yra pagrindinė pirmuonių sukeltų infekcijų gydymo priemonė. Sėkminga chemoterapija priklauso nuo gebėjimo išnaudoti medžiagų apykaitos skirtumus tarp patogeno ir šeimininko. Problema, su kuria susiduriama atliekant chemoterapiją, yra patogeno gebėjimas mutuoti ir tapti atspariu vaistams. Toliau aptariami konkretūs vaistų veikimo mechanizmų ir atsparumo pavyzdžiai.
Vaistų veikimas
Vaistai veikia specifiškai trukdydami ląstelių ar biocheminiams procesams, dažnai vadinamiems „taikiniais“. Klasikinis vaisto taikinio pavyzdys yra fermentas, slopinamas vaisto. Veiksmingi vaistai demonstruoja selektyvų toksiškumą patogenui, o ne šeimininkui. Daugelis veiksnių prisideda prie šio selektyvaus toksiškumo (lentelė) ir šie veiksniai vienas kito nepaneigia. Racionalus vaistų kūrimas siekia išnaudoti šiuos įvairius veiksnius, kad būtų sukurti vaistai, kurie yra labai toksiški patogenui ir tuo pačiu metu turi minimalų toksiškumą šeimininkui.

Chlorokvinas ir maisto vakuolė
Maisto vakuolė yra į lizosomą panaši organelė, kurioje vyksta hemoglobino skaidymas ir hemo detoksikacija. Chlorokvinas parazito maisto vakuolėje koncentruojasi iki 1000 kartų. Galimi šio selektyvaus chlorokvino kaupimosi maisto vakuolėje mechanizmai yra šie: 1) chlorokvino protonacija ir jonų sulaikymas dėl žemo maisto vakuolės pH; 2) parazitų nešėjo (-ų) aktyvus chlorokvino pasisavinimas; ir (arba) 3) chlorokvino prisijungimas prie specifinio receptoriaus maisto vakuolėje.
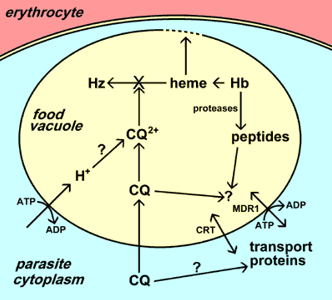
Chlorokvinas (CQ) kaupiasi parazito maisto vakuolėje. Šis kaupimasis gali apimti jonų sulaikymą po protonacijos, specifinį nešėją ir (arba) prisijungimą prie receptoriaus (pvz., hemo). Pagrindinis chlorokvino veiksmas yra slopinti hemozoino (Hz) susidarymą iš hemo, išsiskiriančio virškinant hemoglobiną (Hb). Tada laisvasis hemas lizuoja membranas ir sukelia parazitų mirtį. Atsparumas chlorokvinui atsiranda dėl sumažėjusio chlorokvino kaupimosi maisto vakuolėje. Du skirtingi nešėjai (CRT ir MDR1) buvo susiję su atsparumu. Šių nešėjų funkcijos ir tikslus jų vaidmuo chlorokvino atsparumui nėra žinomi.
Tikslus šių trijų postuluojamų mechanizmų indėlis nėra aiškus, tačiau visuotinai pripažįstama, kad chlorokvinas daro toksinį poveikį, trukdydamas laisvo hemo pavertimui hemozoinu. Didelis hemo kiekis išsiskiria dėl hemoglobino virškinimo maisto vakuolėje. Laisvas hemas gali lizuoti membranas, sukelti reaktyvių deguonies tarpinių produktų susidarymą ir slopinti daugelį kitų procesų, todėl yra gana toksiškas. Hemas yra detoksikuojamas maisto vakuolėje per biokristalizacijos procesą, kurio metu hemas yra atskiriamas į didelius netirpius kristalus, vadinamus hemozoinais arba maliarijos pigmentu. Tikslus mechanizmas, kuriuo chlorokvinas slopina hemozoino susidarymą, nėra žinomas, tačiau chlorokvinas gali prisijungti hemą ir šis prisijungimas gali užkirsti kelią hemo įtraukimui į hemozoino kristalą. Todėl parazitų naikinimas yra medžiagų apykaitos atliekų (t.y. hemo), susijusių su hemoglobino virškinimu, kaupimasis.
Kiti chinolino turintys vaistai nuo maliarijos, tokie kaip meflokvinas ir chininas, taip pat veikia maisto vakuolę. Tačiau neaišku, ar šie vaistai jungiasi su hemu, ar veikia hemozoino susidarymą. Be to, šie vaistai yra silpnesnės bazės nei chorokvinas ir gali nedemonstruoti tokio pat jonų sulaikymo maisto vakuolėje.
Maisto vakuolėje yra daug galimų vaistų taikinių. Be aukščiau aptarto hemozoino susidarymo slopinimo, specifiniai proteazių inhibitoriai, dalyvaujantys hemoglobino virškinime, taip pat yra tiriami kaip galimi vaistai nuo maliarijos. Specializuotos hemoglobino virškinimo ir hemozoino susidarymo funkcijos būdingos tik parazitui, šeimininke jų nėra. Be to, abi funkcijos – aminorūgščių generavimas iš hemoglobino ir hemo detoksikacija – yra labai svarbios parazitui.
Antifolatai
Folio rūgšties metabolizmas yra kelių antimaliarinių vaistų, taip pat vaistų, vartojamų prieš kitus patogenus, taikinys. Sumažinti folatai yra daugelio vieno anglies perdavimo reakcijų, dalyvaujančių aminorūgščių ir nukleotidų biosintezėje, kofaktorius. Dėl didelio replikacijos greičio maliarijos parazitas turi didelį nukleotidų, kaip DNR sintezės pirmtakų, poreikį, todėl yra ypač jautrus antifolatams. Du pagrindiniai antifolato metabolizmo tikslai yra de novo folatų ir dihidrofolato reduktazės (DHFR) biosintezė.
Maliarijos parazitas sintezuoja folatus de novo, o žmogaus šeimininkas turi gauti iš anksto suformuotus folatus ir negali sintetinti folio rūgšties. Dėl to, kad parazitas nesugeba panaudoti egzogeninių folatų, folatų biosintezė yra geras vaisto taikinys. Folatas sintetinamas iš 3 pagrindinių statybinių blokų – GTP, paraaminobenzoinės rūgšties (pABA) ir glutamato, dalyvaujant 5 fermentams. Vieną iš šių fermentų – dihidropteroato sintazę (DHPS) – slopina vaistai, kurių sudėtyje yra sulfa. Sulfadoksinas ir dapsonas yra du įprasti vaistai nuo maliarijos, kurie nusitaiko į DHPS. Sulfa vaistai yra struktūriniai pABA analogai, kuriuos DHPS paverčia į nemetabolizuojamus aduktus. Dėl to išsenka folatų telkinys ir taip sumažėja DNR sintezei reikalingo timidilato kiekis.
Supaprastinta folatų metabolizmo schema. Maliarijos parazitas de novo sintetina folatus, bet negali panaudoti iš anksto suformuotų folatų. Folatai dalyvauja kaip kofaktoriai daugelyje biosintezės procesų. Ypatingas dėmesys skiriamas timidilato (dTMP) sintezei, kuri reikalinga DNR sintezei. Du pagrindiniai antimalarinių vaistų, nukreiptų į folio rūgšties metabolizmą, taikiniai pažymėti didesnėmis rodyklėmis.
DHFR yra visur esantis fermentas, dalyvaujantis folatų perdirbime, redukuodamas dihidrofolatą į tetrahidrofolatą. Tada tetrahidrofolatas vėl oksiduojamas į dihidrofolatą, nes dalyvauja biosintetinėse reakcijose (pvz., timidilato sintazė). DHFR slopinimas užkirs kelią timidilato susidarymui ir sustabdys DNR sintezę, o vėliau ir sunaikins parazitus. Pirimetaminas ir proguanilis yra du dažniausiai vartojami DHFR inhibitoriai, kaip vaistai nuo maliarijos. Šie vaistai labiau slopina parazito DHFR nei šeimininko fermentas, todėl parazitui demonstruoja selektyvų toksiškumą.
Dažniausiai DHPS ir DHFR inhibitoriai naudojami kartu (lentelė) siekiant sinergetinio poveikio ir sulėtinti atsparumo vaistams vystymąsi. Dėl specifinių taškinių mutacijų šiuose fermentuose sumažėja trauka vaistams. Atsparumas greitai vystosi esant vaistų spaudimui, kai viena mutacija gali sukelti atsparumą vaistams. Vaistų derinių naudojimas sulėtins atsparumo vystymąsi, nes turi įvykti dvi nepriklausomos mutacijos, kad susidarytų atsparumas abiem vaistams. Fansidaras, sulfadoksino ir pirimetamino derinys, plačiai naudojamas nekomplikuotai cerebrinei maliarijai gydyti. Trimetoprimas, panašus į pirimetaminą, dažniausiai naudojamas kartu su kitais sulfa vaistais kokcidijų (Toxoplasma, Cyclospora ir Isospora) ir Pneumocistinių infekcijų gydymui.


Vaistai, susiję su oksidacijos-redukcijos mechanizmais
Manoma, kad kai kurie vaistai nuo pirmuonių veikia per oksidacinį stresą (lentelė). Metabolizmo procesai gamins reaktyvius deguonies produktus (ROI), kurie gali pažeisti ląstelių komponentus, tokius kaip lipidai, baltymai ir nukleorūgštys. Didelis daugumos pirmuonių patogenų metabolizmo aktyvumas sukels dar didesnį ROI lygį. Tai rodo maliarijos parazitas, kuris gamina ROI dėl hemoglobino virškinimo ir laisvojo hemo išsiskyrimo. Visos ląstelės turi mechanizmus, kuriais ROI gali būti detoksikuojamas (pvz., oksidacijos-redukcijos metabolizmas). Vaistai, kurie specifiškai padidina parazito oksidacinio streso lygį, gali įveikti šiuos ROI gynybos mechanizmus ir sunaikinti parazitą. Oksidacinio streso lygį gali padidinti vaistai, kurie yra tiesioginiai oksidatoriai, taip pat vaistai, dalyvaujantys oksidacijos-redukcijos cikle, kartais vadinamame beprasmiu oksidacijos-redukcijos ciklu.
Daugelis vaistų, dalyvaujančių oksidacijos-redukcijos reakcijose, turi būti aktyvuoti, kad jie būtų veiksmingi kovojant su taikiniu (-iais). Pavyzdžiui, metronidazolas ir kiti nitroimidazolai yra plataus veikimo spektro vaistai, veikiantys įvairias anaerobines bakterijas ir pirmuonis. Šie vaistai aktyvuojami redukuojant nitro grupę į anijonų radikalą. Anijoninis radikalas yra labai reaktyvus ir sudaro jungtis su baltymais ir DNR, todėl prarandama jo funkcija. Visų pirma dėl reakcijų su DNR nutrūksta grandinės ir sutrinka replikacija, todėl ląstelės žūsta. Nitroimidazolų kiekio mažinimui reikalingos stiprios redukcijos sąlygos, o anaerobiniai organizmai turi didesnį redukcijos potencialą nei aerobiniai organizmai. Tai lemia šių junginių selektyvumą anaerobiniams organizmams. Kitaip tariant, vaistus pirmiausia aktyvuoja patogenai.
Kalbant apie metronidazolą, redukuotas feredoksinas yra pagrindinis elektronų donoras, atsakingas už jo mažinimą (paveikslėlis). Stiprus ryšys yra tarp piruvato-feredoksino oksidoreduktazės (PFOR) buvimo ir jautrumo metronidazolui. Visiems trims pirmuoniams, paveiktiems metronidazolo (lentelė), trūksta mitochondrijų ir PFOR yra panašus į tą, kuris randamas daugelyje anaerobinių bakterijų. Aerobiniai organizmai su mitochondrijomis naudoja piruvato dehidrogenazę vietoje PFOR acetilkofermento A gamybai.
Nitroimidazolų poveikis. Parazitas aktyvuoja nitroimidazolus (R-NO2), redukuodamas į anijonų radikalą. Šis labai reaktyvus anijonų radikalas pažeis DNR ir baltymus, o tai sukels parazito mirtį. Atrodo, kad feredoksinas specifiškai sumažina metronidazolą Giaridia, Entamoeba ir Trichomonas. Aerobiniai organizmai naudotų kitus elektronų donorus nitroimidazolų kiekiui sumažinti, taip pat būtų galimybė sukurti beprasmius oksidacijos-redukcijos ciklus, dėl kurių susidarytų ROI, kuriuose deguonis yra paskutinis elektronų akceptorius. Paprastai NAD oksidoreduktazės atlieka oksidacijos-redukcijos ciklą, kurio galutinis produktas yra vanduo.
Nitroimidazolai (pvz., benznidizolas) ir panašūs nitrofurano junginiai (pvz., nifurtimoksas) taip pat yra veiksmingi prieš Trypanosoma cruzi. Elektronų donorai, atsakingi už pradinę šių vaistų redukciją, nėra žinomi, o parazito specifiškumo pagrindas nėra aiškus. Abu šie vaistai yra šiek tiek toksiški ir neturi gerų gydomųjų rodiklių. Manoma, kad nifurtimokso veikimo mechanizmas apima beprasmį oksidacijos-redukcijos ciklą po redukcijos, tuo tarpu spėjama, kad benznidizolas slopina specifines reduktazes ir taip sumažina parazito gebėjimą pašalinti ROI.
Oksidacinis stresas ir G6PD trūkumas
Yra žinoma, kad kelios žmogaus genetinės ligos suteikia tam tikrą apsaugą nuo maliarijos (žr. įgimtą atsparumą). Asmenų, kuriems trūksta gliukozės-6-fosfato dehidrogenazės (G6PD), eritrocituose bus mažesnis NADPH kiekis, kuris yra reikalingas palaikyti sumažintą glutationo kiekį. Mažesnis glutationo kiekis padidins jautrumą oksidaciniam stresui, nes glutationo peroksidazė dalyvauja detoksikuojant ROI. Padidėjęs ROI lygis dėl parazito metabolizmo kartu su sumažėjusiu G6PD eritrocitų gebėjimu pašalinti ROI sukels ankstyvą užkrėsto eritrocito lizaciją ir dėl to suteiks tam tikrą apsaugą nuo maliarijos. Parazitas turi ne tik apsisaugoti nuo ROI, bet ir užtikrinti, kad šeimininko eritrocitas nebūtų pažeistas, kol parazitas nebaigs eritrocitinės šizogonijos. Yra manoma, kad parazitas gali aprūpinti šeimininko eritrocitą glutationu, kad padidintų jo redukcinį pajėgumą. Panašus gydymas primakvinu yra draudžiamas pacientams, kuriems trūksta G6PD, nes jis gali sukelti hemolizinę anemiją. Tikėtina, kad tai susiję su primakvino gebėjimu gaminti ROI ir sumažėjusiomis eritrocitų, kuriems trūksta G6PD, mažinimo galimybėmis
Atsparumas vaistams
Atsparumo vaistams atsiradimas labai apriboja prieinamų vaistų nuo pirmuonių patogenų arsenalą. Parazitai įvairiai vystėsi ir evoliucionavo, kad įveiktų vaistų toksiškumą (lentelė). Gana dažnai atsparumas vaistams apima vaisto taikinio mutacijas, todėl vaistas taip pat nesusieja arba neslopina taikinio. Atsparumas vaistams gali greitai išsivystyti situacijose, kai vieno taško mutacija gali sukelti atsparumą. Kitas atsparumo vaistams mechanizmas apima aukštesnio taikinio lygio išreiškimą. Tai galima pasiekti padidinus transkripciją ir transliaciją arba genų amplifikaciją. Dėl to reikia didesnio vaistų kiekio, kad būtų pasiektas toks pat slopinimo lygis. Sumažinus vaistų kaupimąsi arba jį metabolizavus į netoksiškus produktus, mažiau vaistų pasieks tikslą ir tai gali prisidėti prie atsparumo vaistams. Atsparumas vaistams taip pat gali būti susijęs su mutacijų kaupimu tuose pačiuose arba skirtinguose taikiniuose, kurie turės papildomą arba sinergetinį poveikį. Parazitai, turintys mutacijų ar genetinių polimorfizmų, dėl kurių sumažėja jautrumas vaistams, bus atrenkami dėka vaistų sukelto spaudimo.

Kai kuriais atvejais specifinės mutacijos buvo susijusios su atsparumu vaistams (lentelė). Atsparumas fansidarui (SP) koreliuoja su specifinėmis mutacijomis fermentuose, kurių taikinys yra sulfadoksinas ir pirimetaminas (atitinkamai dihidropteroato sintetazė ir dihidrofolato reduktazė). Atsparumas chlorokvinui (išsamiau aptariama žemiau) buvo koreliuojamas su pernešėjo mutacijomis, esančiomis ant maisto vakuolės membranos (atsparumo chlorokvinui nešėjas, CRT). Manoma, kad kitas maisto vakuolių pernešėjas, daugelio vaistų atsparumo genas 1 (MDR1), atlieka papildomą vaidmenį atsparume. Atsparumo meflokvinui ir kvininui pagrindas nėra aiškus, tačiau taip pat susijęs su mdr1 genu.
Chlorokvinas. Atsparumas chlorokvinui yra susijęs su chlorokvino kiekio sumažėjimu maisto vakuolėje, chlorokvino veikimo vietoje (žr. aukščiau). Šio sumažėjusio kaupimosi mechanizmas yra prieštaringas. Kai kurie tyrimai parodė, kad vaistų kaupimosi sumažėjimą lemia padidėjęs vaistų nutekėjimas. Tuo tarpu kiti tyrimai rodo, kad sumažėjęs chlorokvino kaupimosi lygis yra svarbesnis. Pastebėjimas, kad verapamilis ir susiję vaistai gali pakeisti chlorokvinui atsparų fenotipą, paskatino spėlioti, kad nuo ATP priklausomas pernešėjas vaidina svarbų vaidmenį vaistų nutekėjime ir atsparume chlorokvinui, panašiai kaip atsparumas daugeliui vaistų (MDR) sergant vėžiu. Maisto vakuolės membranoje buvo identifikuotas į MDR panašus pernešėjas, pažymėtas PfMDR1. Tačiau nebuvo įrodyta jokių užtikrintų koreliacijų tarp PfMDR1 ir atsparumo chlorokvinui. Vis dėlto negalima atmesti papildomo PfMDR1 vaidmens atsparume chlorokvinui.
Atlikus genetinius kryžminimo ir kartografavimo tyrimus tarp chlorokvinui atsparaus klono ir chlorokvinui neatsparaus klono, buvo nustatyta, kad 36 kb sritis 7 chromosomoje yra susijusi su atsparumu chlorokvinui. Vienas iš 10 genų šiame 36 kb regione koduoja baltymą su 10 transmembraninių domenų ir primena baltymą pernešėją, panašų į chlorido kanalus. Genas buvo pažymėtas kaip pfcrt, o baltymas yra lokalizuotas maisto vakuolės membranoje. Kelios pfcrt geno mutacijos rodo koreliacijas su atsparumo chlorokvinui fenotipu ir viena mutacija, treonino (T) pakeitimas lizinu (K) 76 likutyje (K76T) rodo tobulą koreliaciją su atsparumu chlorokvinui. Manoma, kad šios mutacijos turi įtakos chlorokvino kaupimuisi maisto vakuolėje, tačiau tikslus atsparumo chlorokvinui mechanizmas nėra žinomas. Be to, pastebėjus, kad atsparumas chlorokvinui atsirado nedaug kartų, o vėliau išplito, paskatino spėlioti, kad su atsparumo vystymusi yra susiję keli genai.
Papildomai skaitykite:
Foley M and Tilley L (1998) Quinoline antimalarials. Mechanisms of action and resistance and prospects for new agents. Pharmacology & Therapeutics 79:55
Hyde JE (2007) Drug-resistant malaria -- an insight.
FEBS Journal 274, 4688-4698.
Ouellette M (2001) Biochemical and molecular mechanisms of drug resistance in parasites. Trop Med Int Health 6:874.
Rosenthal PJ and Goldsmith RS (2001) Antiprotozoal drugs. In Basic and Clinical Pharmacology, 8th edition. McGraw-Hill Companies Inc. (On-line edition available through
Stat!Ref Books at the Tulane Medical Library)
Samuelson J (1999) Why metronidazole is active against both bacteria and parasites. Antimicrob Agents Chemother. 43:1533.
Wellems TE and Plowe CV (2001) Chloroquine-resistant malaria. J Inf Dis 184:770.
Original article: http://www2.tulane.edu/~wiser/protozoology/notes/drugs.html




